“醫美歸醫”再進一(yī)步,醫用透明質酸鈉監管新規之下(xià)的企業進入新階段
在醫美産業筆記今年發起的「線上直播大(dà)課」中(zhōng),一(yī)位資(zī)深連麥嘉賓總結過:“未來醫美行業的機會點主要來自三個方面:一(yī)是國家經濟的高速發展;二是醫美行業的發展;三是行業監管的規範化。”
近兩年,醫美行業的監管政策尤其引人注目,一(yī)方面政策的強監管爲醫美行業的粗放(fàng)式發展敲響了警鍾;另一(yī)方面,則爲醫美行業的可持續發展提供了堅實基礎。不管是長期還是短期來看,嚴監管都利好行業上下(xià)遊的龍頭企業。
11月14日,國家藥監局對外(wài)發布《關于醫用透明質酸鈉産品管理類别的公告(2022年第103号)》(以下(xià)簡稱“《公告》”),以加強醫用透明質酸鈉(玻璃酸鈉)産品的監督管理,進一(yī)步規範相關産品注冊(備案)。
據統計,這是今年第三份比較完善的關于“透明質酸鈉”的監管公告。3月30日國家藥品監督管理局對外(wài)發布《關于調整《醫療器械分(fēn)類目錄》部分(fēn)内容的公告(2022年第30号)》,初步明确了注射用透明質酸鈉、膠原蛋白(bái)植入劑等按三類醫療器械監管;5月國家藥監局發布公開(kāi)征求《關于醫用透明質酸鈉産品管理類别的公告》(修訂草案征求意見稿),将此前的内容細分(fēn)和完善,聚焦在醫用透明質酸鈉上,規定了11種使用情況下(xià)的監管類别;今年11月真正将此前的意見稿作爲《公告》發布,可見對透明質酸鈉監管的逐漸成熟。
《公告》中(zhōng)明确指出:作爲注射填充增加組織容積産品和注射到真皮層,主要通過所含透明質酸鈉的保濕、補水等作用,改善皮膚狀态應用時,按照第三類醫療器械管理。
透明質酸鈉作爲中(zhōng)國醫美行業應用廣泛的一(yī)大(dà)品類,在市場發展和監管方面都越來越成熟。政策對醫美市場的重塑與清洗,正引導行業回歸理性,尤其是對于具有先發優勢和強大(dà)實力的企業來說,嚴監管更加利好龍頭企業。
所以作爲能一(yī)直符合甚至超過國家監管标準的上遊企業,在新規落地之後能釋放(fàng)出更多的發展活力,赢在“起跑線”上。
高于行業标準的高品質透明質酸鈉什麽樣?
縱觀所有行業,監管尚未落地之前,行業就沒有一(yī)個準入門檻。此時,行業内産品魚龍混雜(zá)、良莠不齊。當行業監管落地并且一(yī)再精細化之後,能砍掉大(dà)部分(fēn)“不合規”的産品,一(yī)直走在行業監管之前、高于行業标準的優質産品必定能赢得更大(dà)的想象空間。
在醫用透明質酸鈉領域,除了以上類别的監管,其實還有更細分(fēn)的行業标準。組織工(gōng)程醫療器械産品《透明質酸鈉 YY/T 1571-2017行業标準》中(zhōng)明确規定了決定透明質酸鈉品質的幾個關鍵因素的數值,内毒素<0.05EU/mg、核酸<0.5、蛋白(bái)質<0.1。
作爲國内少數擁有中(zhōng)國GMP證書(shū),并且原料藥登記号爲A狀态的玻璃酸鈉原料藥生(shēng)産企業,衆山生(shēng)物(wù)于2021年,依據組織工(gōng)程醫療器械産品《透明質酸鈉 YY/T 1571-2017行業标準》,推出了醫用級透明質酸鈉系列MEDIHYA®,且該系列産品矩陣不斷完善,針對醫美市場不同層級原料需求做出了差異化産品線。
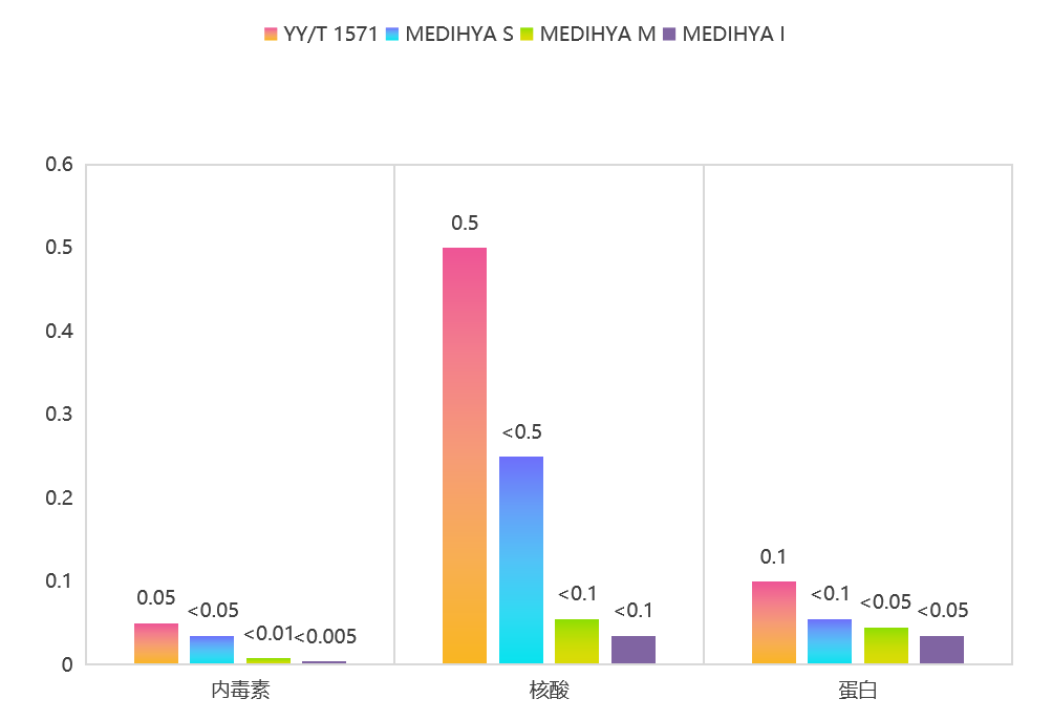
衆山生(shēng)物(wù)産品品質一(yī)如既往的優于行業标準,該系列的産品同樣可應用于Ⅲ類醫療器械,用作醫美填充、水光、胸腹部抗粘連及美體(tǐ)手術、人工(gōng)皮膚移植手術等。與《公告》中(zhōng)規定的“作爲注射填充增加組織容積産品和注射到真皮層,主要通過所含透明質酸鈉的保濕、補水等作用,改善皮膚狀态應用時,按照第三類醫療器械管理”相契合。
而談到産品品質,則一(yī)定要依靠試驗得出的科學結論。在2021年7月,權威檢測機構對衆山生(shēng)物(wù)産品進行了細胞毒性、皮膚緻敏性、皮内安全性、急性全身毒性等多項生(shēng)物(wù)學測試,檢測結果均顯示本品在生(shēng)物(wù)體(tǐ)内是具有高度安全性的。針對《關于醫用透明質酸鈉産品管理類别的公告(2022年第103号)》中(zhōng)“作爲醫用敷料應用時,不可被人體(tǐ)吸收且用于非慢(màn)性創面,醫用敷料按照第二類醫療器械管理”的這一(yī)要求,完成了“産品不透皮吸收”和“創面不透皮”的功效實驗,進一(yī)步拓寬了産品應用範圍,同時也爲後續産品合規劃化審批提供充足的實驗數據支持。
其次,從衆山生(shēng)物(wù)本身的産品布局來看,目前推出的醫用級透明質酸鈉系列MEDIHYA®有四款産品,MEDIHYA®I和MEDIHYA®M是醫療注射級透明質酸鈉、MEDIHYA®S是醫療器械級透明質酸鈉、MEDIHYA®T是醫療外(wài)用級透明質酸鈉,涵蓋醫美用品中(zhōng)從外(wài)用到注射所有符合标準的産品。其中(zhōng)内毒素水平更是做到了僅爲歐洲藥典标準值的1/50。
企業的全維度升級給行業帶來更多想象力
醫美行業發展到今天,監管帶來的變化一(yī)定程度上推動了行業發展,促進市場逐漸成熟。想要真正站在賽道的前沿,産品力固然是第一(yī)核心驅動,但是還需要從全局入手,提升企業整體(tǐ)實力。
在透明質酸鈉原料領域深耕17年的衆山生(shēng)物(wù),以微生(shēng)物(wù)發酵技術和無菌原料生(shēng)産技術爲核心。産品覆蓋生(shēng)化原料藥、組織工(gōng)程學原材料、功能性護膚成分(fēn)等領域,其中(zhōng)核心成分(fēn)透明質酸鈉系列,可應用于醫藥(骨科、眼科)、醫學美容(真皮填充劑)、化妝品、健康食品等。據了解,到2018年,化妝品級HA産能便擴大(dà)到50噸,滿足市場日益增長的需求。
這一(yī)方面得益于衆山生(shēng)物(wù)基礎設施的加速擴建,截至目前,公司總占地已經達到了10萬餘平方米,建有8個符合GMP标準的生(shēng)産車(chē)間和符合GLP标準化的實驗室;另一(yī)方面則得益于專業認證地加速推進和研發實力的不斷強大(dà),衆山生(shēng)物(wù)現有中(zhōng)級以上職稱30多人,執業藥師30多人,擁有專利30餘項,科技成果鑒定達到國際先進3項,新産品4項,國家三類新藥11項,歐美等各種國際認證7項,品牌商(shāng)标35項,參與國家藥典标準修訂一(yī)項。
最重要的是,衆山生(shēng)物(wù)是國内少數擁有中(zhōng)國GMP證書(shū)的透明質酸鈉原料藥生(shēng)産企業之一(yī),并且原料藥登記号爲A狀态。
在透明質酸鈉市場不斷擴張的今天,爲滿足更高的需求,衆山投入大(dà)量的資(zī)金、人力、物(wù)力,設計并研發出中(zhōng)國第一(yī)條無菌HA車(chē)間,可以爲衆多需求高的企業生(shēng)産無菌透明質酸鈉。
也正是衆山生(shēng)物(wù)在專業領域的持續深耕,目前已發展成爲全球醫藥級透明質酸領先生(shēng)産企業、國内無菌玻尿酸原材料領航生(shēng)産企業。并獲得國家級小(xiǎo)巨人企業、高新技術企業、省專精特新、市瞪羚企業、省科技型中(zhōng)小(xiǎo)企業、創新優勝企業、山東省先進中(zhōng)小(xiǎo)企業、山東名牌、市長質量獎提名等多項榮譽稱号。
衆山生(shēng)物(wù)之所以能成爲走在行業前沿的企業,除專業的産品和專業的認證之外(wài),還有一(yī)整套完備的服務流程。首先以豐富的産品矩陣爲基礎,衆山生(shēng)物(wù)能滿足客戶多樣化的需求,爲客戶定制服務和産品。就以MEDIHYA®系列爲例,其産品能針對不同功效應用到各類醫療器械産品中(zhōng);能精準控制10萬-300萬範圍内分(fēn)子量,完全滿足客戶定制化需求。
其次,衆山生(shēng)物(wù)以強大(dà)的研發力爲基石,不僅自身積累了原料藥的生(shēng)産和資(zī)質基礎,還能爲客戶在産品申報時提供全套生(shēng)物(wù)學評價等資(zī)料,更好地進行變更及申報。
衆山生(shēng)物(wù)的“服務優勢”不僅如此,還包括運輸方案的制定及服務。衆所周知(zhī),透明質酸鈉因其特殊性,運輸中(zhōng)需冷藏,控制溫度以保障産品活性和有效性。衆山生(shēng)物(wù)的「溫控」運輸方案能在10天時間裏讓溫度幾乎保持恒定,最大(dà)程度地保障了産品的有效性。
2022年是整個醫美行業“合規化”再次邁向一(yī)個新高度的一(yī)年,關于「透明質酸鈉」的政策新規不斷湧現,整個領域也處于破舊(jiù)立新的轉折期,需要更多頭部品牌和專業力量的加持和帶領,才能同監管部門一(yī)道爲行業合規化做出貢獻。以衆山生(shēng)物(wù)爲代表的領軍企業不斷以專業品質助推行業前行,相信未來也将進一(yī)步引領行業,獲得長遠發展。
如有讀者希望對接“衆山生(shēng)物(wù)”,可直接撥打電話(huà)咨詢:0532-80821290












